Mekanika kuantum adalah cabang dasar fisika yang menggantikan mekanika klasik pada tataran atom dan subatom. Ilmu ini memberikan kerangka matematika untuk berbagai cabang fisika dan kimia, termasuk fisika atom, fisika molekular, kimia komputasi, kimia kuantum, fisika partikel, dan fisika nuklir. Mekanika kuantum adalah bagian dari teori medan kuantum dan fisika kuantum umumnya, yang, bersama relativitas umum, merupakan salah satu pilar fisika modern. Dasar dari mekanika kuantum adalah bahwa energi itu tidak kontinyu, tapi diskrit -- berupa 'paket' atau 'kuanta'. Konsep ini cukup revolusioner, karena bertentangan dengan fisika klasik yang berasumsi bahwa energi itu berkesinambungan.
Bukti dari mekanika kuantum
Mekanika kuantum sangat berguna untuk menjelaskan perilaku atom dan partikel subatomik seperti proton, neutron dan elektron yang tidak mematuhi hukum-hukum fisika klasik. Atom biasanya digambarkan sebagai sebuah sistem di mana elektron (yang bermuatan listrik negatif) beredar seputar nukleus atom (yang bermuatan listrik positif). Menurut mekanika kuantum, ketika sebuah elektron berpindah dari tingkat energi yang lebih tinggi (misalnya dari n=2 atau kulit atom ke-2 ) ke tingkat energi yang lebih rendah (misalnya n=1 atau kulit atom tingkat ke-1), energi berupa sebuah partikel cahaya yang disebut foton, dilepaskan. Energi yang dilepaskan dapat dirumuskan sbb:
keterangan:
adalah energi (J)
adalah tetapan Planck, (Js), dan
adalah frekuensi dari cahaya (Hz)
Dalam spektrometer massa, telah dibuktikan bahwa garis-garis spektrum dari atom yang di-ionisasi tidak kontinyu, hanya pada frekuensi/panjang gelombang tertentu garis-garis spektrum dapat dilihat. Ini adalah salah satu bukti dari teori mekanika kuantum.
Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri (lihat pula katalisis). Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk.
Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru. katan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
- A + C → AC (1)
- B + AC → AB + C (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi,
- A + B + C → AB + C
katalis tidak termakan atau pun tercipta. Enzim adalah biokatalis. Penggunaan istilah "katalis" dalam konteks budaya yang lebih luas, secara bisa dianalogikan dengan konteks ini.
beberapa katalis ternama yang pernah dikembangkan di antaranya katalis Ziegler-Natta yang digunakan untuk produksi masal polietilen dan polipropilen. Reaksi katalitik yang paling dikenal ialah proses Haber untuk sintesis amoniak, yang menggunakan besi biasa sebagai katalis. Konverter katalitik--yang dapat menghancurkan produk samping knalpot yang paling bandel--dibuat dari platinadan rodium.
Inhibitor
Inhibitor adalah zat yang menghambat atau menurunkan laju reaksi kimia. Sifat inhibitor berlawanan dengan katalis, yang mempercepat laju reaksi.
Inhibitor korosi
Inhibitor korosi adalah zat yang dapat mencegah atau memperlambat korosi logam.Inhibitor enzim
Dalam biokimia, inhibitor umumnya terbatas pada enzim. Dalam hal ini, inhibitor berarti senyawa non-protein yang menghambat kerja enzim.Laju reaksi
Laju reaksi atau kecepatan reaksi menyatakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatakan molaritas zat terlarut dalam reaksi yang dihasilkan tiap detik reaksi. Perkaratan besi merupakan contoh reaksi kimia yang berlangsung lambat, sedangkan peledakan mesiu atau kembang api adalah contoh reaksi yang cepat.
Laju reaksi dipelajari oleh cabang ilmu kimia yang disebut kinetika kimia.
Faktor yang mempengaruhi laju reaksi
Luas permukaan sentuh
Luas permukaan sentuh memiliki peranan yang sangat penting dalam banyak, sehingga menyebabkan laju reaksi semakin cepat. Begitu juga, apabila semakin kecil luas permukaan bidang sentuh, maka semakin kecil tumbukan yang terjadi antar partikel, sehingga laju reaksi pun semakin kecil. Karakteristik kepingan yang direaksikan juga turut berpengaruh, yaitu semakin halus kepingan itu, maka semakin cepat waktu yang dibutuhkan untuk bereaksi; sedangkan semakin kasar kepingan itu, maka semakin lama waktu yang dibutuhkan untuk bereaksi.Suhu
Suhu juga turut berperan dalam mempengaruhi laju reaksi. Apabila suhu pada suatu reaksi yang berlangusng dinaikkan, maka menyebabkan partikel semakin aktif bergerak, sehingga tumbukan yang terjadi semakin sering, menyebabkan laju reaksi semakin besar. Sebaliknya, apabila suhu diturunkan, maka partikel semakin tak aktif, sehingga laju reaksi semakin kecil.Katalis
Katalis adalah suatu zat yang mempercepat laju reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.Katalis dapat dibedakan ke dalam dua golongan utama: katalis homogen dan katalis heterogen. Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisinya, sedangkan katalis homogen berada dalam fase yang sama. Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerat. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantarakimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
 ... (1)
... (1) ... (2)
... (2)
Molaritas
Molaritas adalah banyaknya mol zat terlarut tiap satuan volum zat pelarut. Hubungannya dengan laju reaksi adalah bahwa semakin besar molaritas suatu zat, maka semakin cepat suatu reaksi berlangsung. Dengan demikian pada molaritas yang rendah suatu reaksi akan berjalan lebih lambat daripada molaritas yang tinggi.Konsentrasi
Karena persamaan laju reaksi didefinisikan dalam bentuk konsentrsi reaktan maka dengan naiknya konsentrasi maka naik pula kecepatan reaksinya. Artinya semakin tinggi konsentrasi maka semakin banyak molekul reaktan yang tersedia dengan demikian kemungkinan bertumbukan akan semakin banyak juga sehingga kecepatan reaksi meningkat.Persamaan laju reaksi
Untuk reaksi kimia
hubungan antara laju reaksi dengan molaritas adalah
- V = Laju reaksi
- k = Konstanta laju reaksi
- m = Orde reaksi zat A
- n = Orde reaksi zat B
Langganan:
Postingan (Atom)
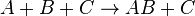
![\,v = k[A]^{n}[B]^{m}](http://upload.wikimedia.org/math/f/5/d/f5d1de7c967051b9e05efcf3c22ee195.png)

